Un nuevo modelo en ratones demuestra la relación entre problemas vasculares y déficits conductuales en el síndrome de Williams
- romeriv
- 9 dic 2025
- 3 Min. de lectura
El síndrome de Williams es una enfermedad genética heterocigótica compleja. Aunque existen formas atípicas, la mayoría de los pacientes presentan una deleción que afecta a 25 genes, mientras que en una subpoblación considerable se produce una deleción más larga que incluye 27 genes.
Las dos formas más prevalentes del síndrome de Williams incluyen la deleción del gen ELN (el gen de la elastina, y relacionado con la mayoría de problemas vasculares en el síndrome), pero el gen NCF1 solo se ve afectado en la deleción más larga. Esto es interesante, ya que existe un efecto de dosis génica de NCF1 en la manifestación de los síntomas cardiovasculares en pacientes con síndrome de Williams.
Los investigadores de este estudio generaron un nuevo modelo en ratones del síndrome de Williams, el modelo LD [Del(5Ncf1-Fkbp6)], que incluye la deleción del gen NCF1 en el lado telomérico, en contraste con el modelo de ratón CD [Del(5Gtf2i-Fkbp6)] creado anteriormente. El modelo LD reproduce los principales síntomas craneofaciales y neurológicos de los pacientes humanos con síndrome de Williams, incluyendo comportamiento hipersocial, sensibilidad auditiva alterada y un déficit motor leve, así como los déficits vasculares típicos, incluyendo estenosis aórtica supravalvular, rigidez aórtica y tortuosidad. A pesar de la alteración de la función cardíaca, en el modelo LD no se observó patología cardíaca con hipertrofia, a diferencia del modelo CD, lo que sugiere la existencia de interacciones genéticas entre los genes NCF1 y ELN.
A pesar de la ausencia de hipertrofia cardíaca, el modelo LD para el síndrome de Williams mostró una vascularización anómala no solo del corazón, sino también del cerebro. Este hallazgo plantea la posibilidad de que los síntomas neuropsicológicos del síndrome de Williams no solo estén causados por la haploinsuficiencia de genes como GTF2I, GTF2IRD1, LIMK1 y CLIP2, sino también por la del gen o genes implicados en la estructura y función de la vasculatura.
El fenotipo de este nuevo modelo en ratón (LD) era aún más completo que en modelos anteriores, con correlaciones estructura-función evidentes en comportamientos auditivos y motores anómalos similares a los de los pacientes con síndrome de Williams. En conjunto, los hallazgos sugieren que no solo los síntomas cardiovasculares, sino también los neuropsicológicos del síndrome de Williams pueden estar provocados en parte por anomalías vasculares que afectan tanto al corazón como al cerebro.
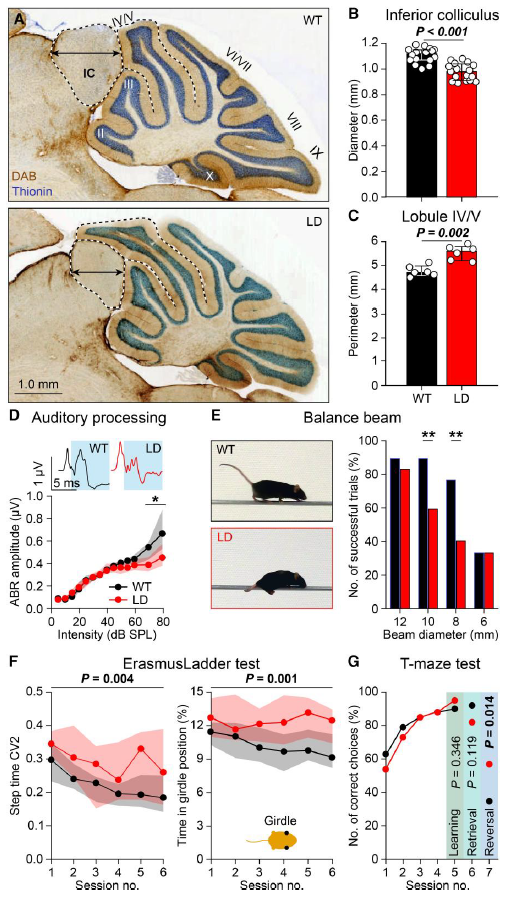
Figura: Síntomas sensoriales, motores y cognitivos en ratones LD. A) Los ratones LD tenían una corteza insular más pequeña y un lóbulo cerebeloso IV/V expandido. B) Disminución del diámetro de la corteza insular en ratones LD. C) El perímetro (línea punteada negra en A) del lóbulo IV/V del cerebelo era mayor en los ratones LD. D) ABR (prueba de sensibilidad a sonidos) representativo en respuesta a un tono de 80 dB SPL, 12 kHz. Los ratones LD mostraron un ABR anormal a tonos >50 dB SPL. E) Con diámetros de barra intermedios, los ratones LD eran menos capaces de caminar por la barra de equilibrio y tendían a gatear. F) En la escalera Erasmus, los ratones LD tenían un patrón de pasos más variable. Al pisar los peldaños, los ratones LD se encontraban con mayor frecuencia en posición de cintura (es decir, con ambas extremidades delanteras tocando los peldaños). G) Tanto los ratones WT como los LD aprendieron rápidamente a elegir el brazo con un refugio en un laberinto en T.

Figura: C) Los ratones LD tienen un cráneo más compacto, lo que se evidencia en un hueso nasal más corto (flecha). D) Los ratones LD mostraron una mayor sociabilidad en la prueba de las tres cámaras. E) Durante la primera fase de la prueba de tres cámaras, los ratones LD se desplazaron menos que sus hermanos WT. F) Los ratones LD enterraron menos canicas . G) Los ratones LD tuvieron un rendimiento normal en la prueba del alambre colgante.
Bosman, L. W., El Azzouzi, H., Kros, L., Ridwan, Y., van Vliet, N., Dijkhuizen, S., ... & De Zeeuw, C. I. (2025). A Del (5 Ncf1-Fkbp6) mouse model of Williams syndrome shows coronary, aortic, and cerebral vascular abnormalities with behavioral deficits. PNAS nexus, 4(11), pgaf359.
El artículo se puede consultar en: https://academic.oup.com/pnasnexus/article/4/11/pgaf359/8321409?login=false


Comentarios